背景
肝脏是人体内最大的实质性器官,承担多种至关重要的生理功能。肝脏疾病严重威胁人民生命健康,肝纤维化是慢性肝病的共同病理终点。肝纤维化的核心是以肝组织中细胞外基质过度沉积和肝星状细胞的持续激活为特征,形成一个自我加剧的恶性循环,导致肝组织变硬和肝功能受损。开发一种能够同时模拟肝纤维化过程中基质刚度变化、三维细胞相互作用以及动态血流剪切力的体外模型,对于深入理解肝纤维化的发病机制以及开发有效的抗纤维化治疗策略具有重要意义。尽管已有研究通过二维模型或静态三维培养模拟纤维化微环境,但目前体外肝组织缺乏肝血窦结构和三维基质环境下的动态力学刺激,导致肝细胞对力学信号响应不足,无法真实再现人体肝纤维化的力学与生物学机制。

针对上述难题,浙江大学流体动力基础件与机电系统全国重点实验室、浙江大学高端装备研究院院长杨华勇院士团队马梁课题组开发了一种工程化可灌流肝纤维化体外模型,通过嵌入式牺牲生物3D打印技术,成功在任意弹性模量的水凝胶中制备出肝血窦结构。 通过“仿生搭建+力学模拟”,研究团队建立了一种以基质刚度调控为中心的可灌注体外肝纤维化模型,成功模拟了肝纤维化微环境中的细胞激活和功能变化。实验结果表明,基质刚度直接驱动肝星状细胞的激活,并通过动态灌注显著增强了肝细胞对高刚度基质的敏感性,更准确地复现了体内肝纤维化微环境下的肝细胞功能下降。此外,该模型还被用于评估针对肝纤维化的药物治疗干预效果,通过靶向抑制关键信号通路,实现了部分逆转激活的肝星状细胞和恢复肝组织功能。这项研究为开发抗肝纤维化策略提供了新的工具,并为未来药物筛选和治疗评估提供了潜在平台。相关成果以“Engineered Perfusable Hepatic Fibrosis Model via Embedded Sacrificial Bioprinting Recapitulates Stiffness-Driven Fibrogenesis”为题发表在《Advanced Materials》期刊上。浙江大学机械工程学院博士研究生吕为康为论文第一作者,浙江大学机械工程学院马梁副教授(我院双聘研究员)为论文通讯作者。第一完成单位为流体动力基础件与机电系统全国重点实验室。该工作得到国家自然科学基金委和浙江省自然科学基金委的支持。
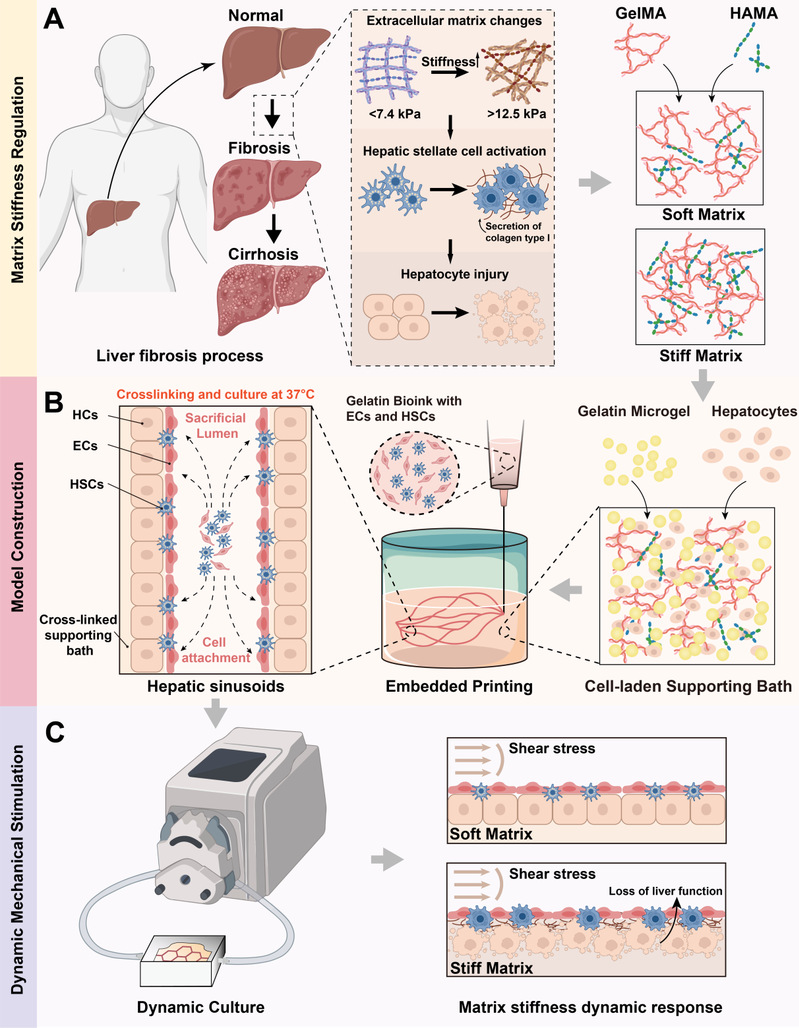
图1 基于基质刚度调节的动态肝纤维化模型
研究亮点
01 精准构建体外三维血管化肝组织,复现肝血窦微环境
研究团队通过嵌入式牺牲生物3D打印技术在水凝胶内生成三维可贯通管腔并实现持续灌流,使模型同时具备血管结构、多细胞分布与剪切力刺激,较传统体外组织模型更接近体内肝血窦微环境。
02 揭示灌流与基质刚度的耦合效应,重现纤维化进程
研究团队将水凝胶刚度从健康到纤维化范围精确可调,验证了“组织硬化、肝星状细胞激活、细胞外基质沉积”的恶性循环过程,实现了肝纤维化的诱导。除此之外,研究发现动态灌流会放大肝细胞在高刚度环境下的功能损伤,使病理表现更贴近体内。
03 探索基质刚度影响纤维化的关键靶点,建立药物筛选平台
研究团队鉴定了参与进行性纤维化过程的关键信号枢纽。通过靶向抑制实现了对硬质基质上肝星状细胞活化的部分逆转,并伴随肝组织功能的恢复,展示其在机制研究与药物筛选上的应用前景。
研究内容
01 基质刚度可调支持浴设计
通过调节GelMA与HAMA比例,制备模量1.57 kPa至27.5 kPa的水凝胶,添加明胶微球优化支撑浴流变性能,并具备快速自修复能力。在上述支撑浴中打印明胶牺牲生物墨水,交联后37℃溶解牺牲材料,形成直径300-600 μm的互通血管网络,蓝色染料灌注验证可灌注性。
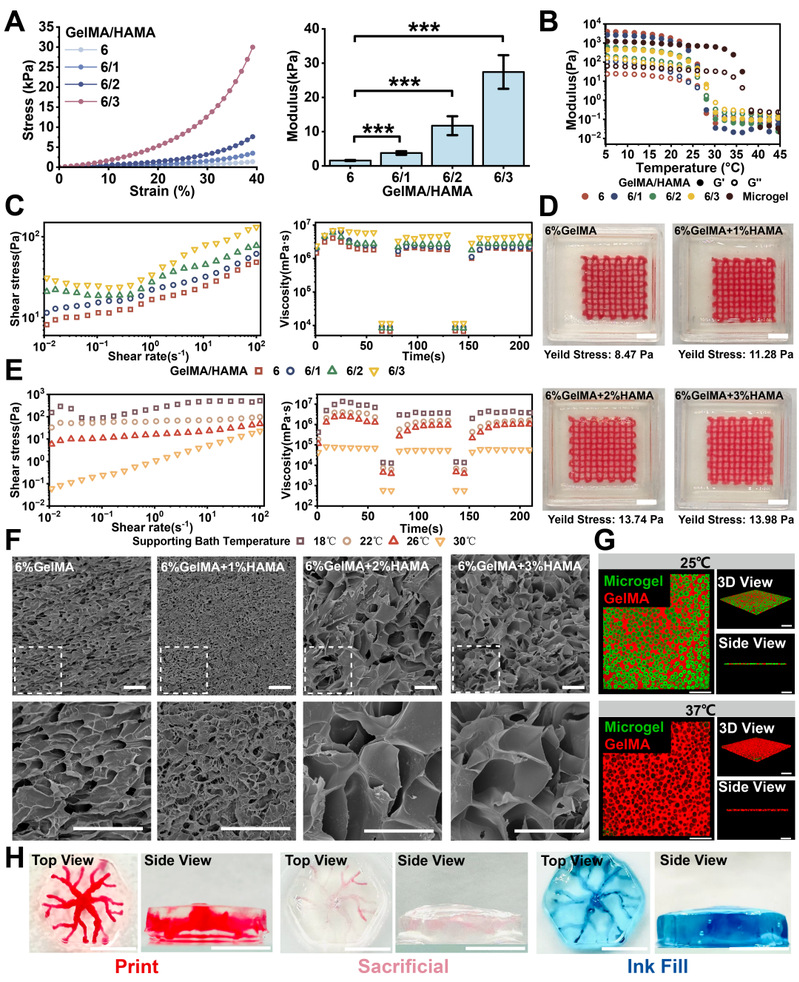
图2 刚度可调的支持浴性能表征
02 肝血窦精准构建与肝组织功能调控
天然的肝组织以肝小叶作为基本单元构成,而其中存在的特殊微血管结构被称为肝血窦,肝血窦主要由内皮细胞与肝星状细胞组成。这些细胞均匀的分布在血管内壁,在肝脏的代谢与免疫反应等过程中扮演着重要角色。研究团队精准构建了具有层级血管的肝小叶组织,并进行了药物毒性测试,证实了具有血管化的肝组织对于药物毒性响应更稳定,具有更高的生理准确性。
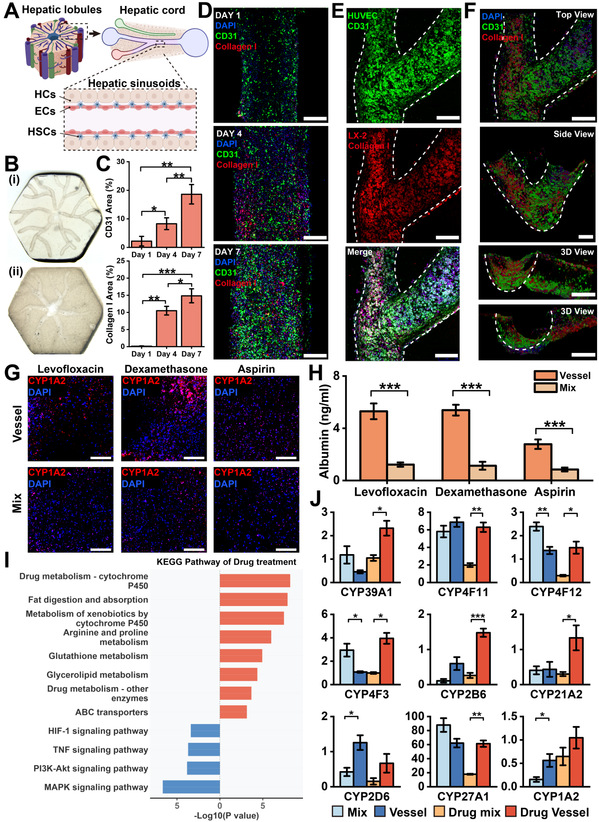
图3 肝血窦构建与药物毒性测试
03 基质刚度协同动态力刺激调控肝纤维化
在体外通过调节基质刚度,使三维环境下的肝星状细胞成功响应物理微环境变换并激活,实现α -SMA、胶原相关基因的高表达。同时肝细胞出现代谢功能障碍,与体内病理特征相似,以此模拟了纤维化过程。通过肝星状细胞在硬基质上的持续培养,观察到一系列与进行性肝纤维化高度相关的关键生物学事件:基质刚度力学信号刺激、整合素上调以及胶原蛋白分泌所共同作用而形成的进行性纤维化。为了更好的还原体内的动态环境,研究团队搭建了灌注平台,动态模型会放大肝细胞在高刚度环境下的功能损伤,同时硬基质上调相关纤维化发生信号通路但抑制肝组织功能,使病理表现更贴近体内,证实血流动力学刺激的必要性。
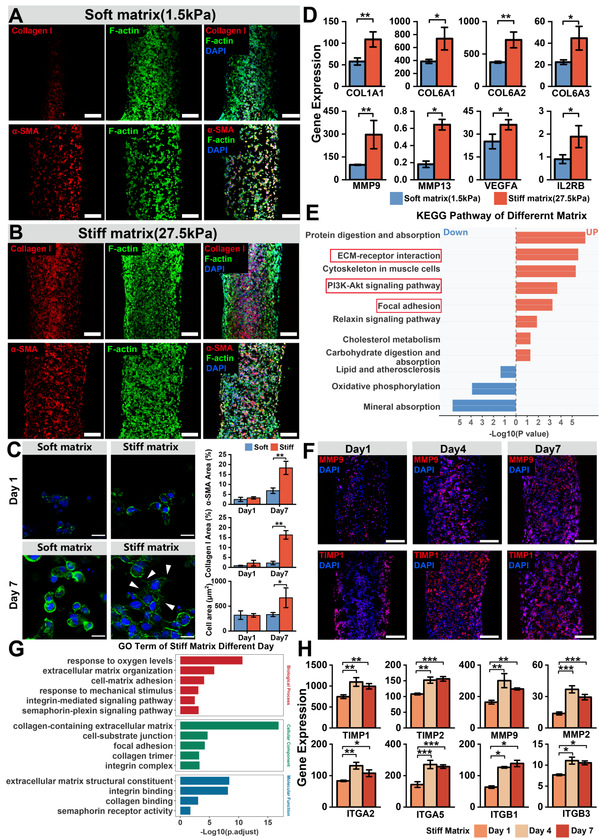
图4 基质刚度调节肝纤维化的进展
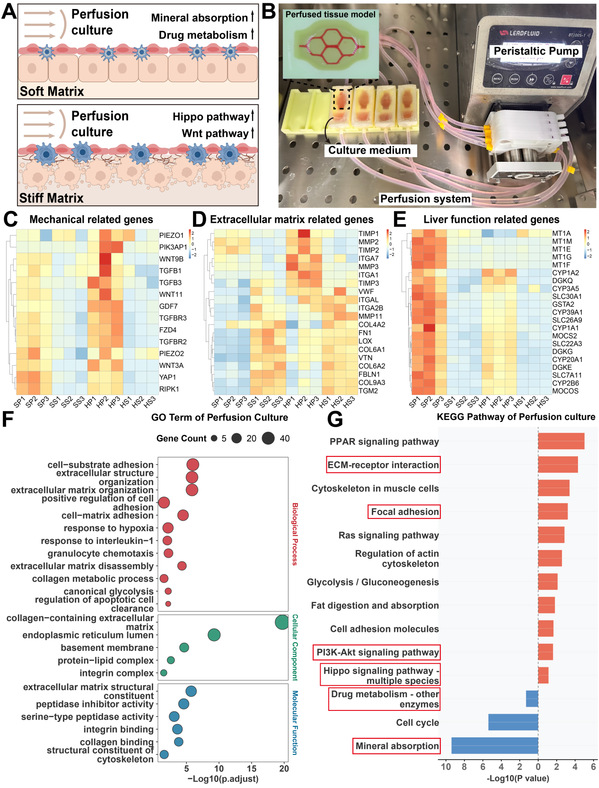
图5 肝血窦构建与药物毒性测试
04 靶向干预肝纤维化
该体外模型不仅重现了肝纤维化的进展过程,而且可以为药物治疗评估提供了一个潜在的平台。研究团队针对于肝纤维化进程的关键靶点进行了抑制。在添加抑制剂以后,肝星状细胞激活的关键基因以及炎症反应相关的关键基因均存在下调情况。同时,研究团队也进一步分析动态环境下抑制剂对于硬基质中肝组织功能的影响,通过靶向抑制实现了对硬质基质上肝星状细胞活化的部分逆转,并伴随肝组织功能的部分恢复,这为评估抗纤维化药物疗效建立了潜在平台。
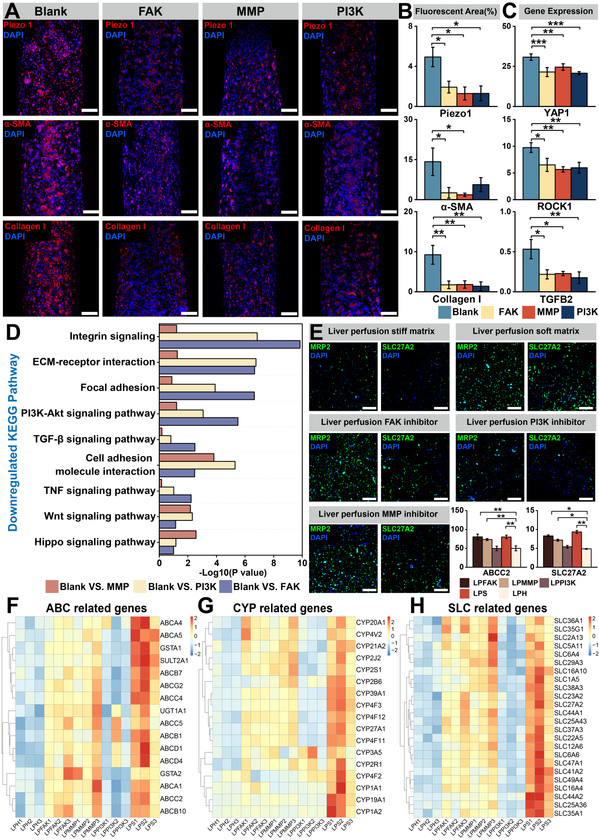
图6 靶向干预肝纤维化
结论
本研究的模型通过同步整合基质刚度调节、三维多细胞相互作用和动态机械力刺激,在体外重现了肝纤维化中细胞外基质沉积,到基质刚度升高,到肝星状细胞活化的恶性循环。通过体外动态培养,解决了传统模型中由于机械刺激不足所导致的肝细胞对生理刚度变化不敏感的问题,为开发针对细胞外基质重塑和机械敏感信号通路的抗纤维化策略提供了新工具。
作者简介
通讯作者:马梁
浙江大学机械工程学院副教授,英国剑桥大学工程系访问学者。2012年博士毕业于美国华盛顿大学,于2016年加入杨华勇院士团队从事生物制造相关研究。他的研究领域包括采用生物3D打印技术,微纳生物制造技术和微流体芯片技术来精确构建体外病药理模型进而进行一系列的诸如药物递送微纳机器人,疾病药物筛选等新型生物医学诊疗方法的研究。他在生物制造与组织工程学领域国际知名期刊Advanced Materials,Bioactive Materials,International Journal of Extreme Manufacturing,Biomaterials,Engineering等国际著名期刊发表高水平SCI论文80余篇,其中20分以上7篇,10分以上18篇,近五年来发表论文篇均影响因子10.95,被引用3600余次,Google Scholar H指数31。参与发起SCI 杂志《生物设计与制造》(Bio-Design and Manufacturing,2023年入选中科院医学大类一区TOP,JCR Q1,影响因子7.6,并担任AE及编辑部副主任(Deputy Director of the Editorial Office)。担任中国生物工程学会类器官与器官芯片分会常务委员在内的多个学会与行业协会委员。
第一作者:吕为康
浙江大学机械工程学院2021级直博生(医工交叉培养),研究方向为体外复杂三维血管化肝组织精准构建。获批国家自然科学基金青年学生基础研究项目(博士研究生)、入选中国科协青年人才托举工程博士生专项计划、入选浙江大学博士研究生求是新星培养计划,以第一作者在Adv. Mater.、Int. J. Extreme Manuf.、Regen. Biomater.期刊发表SCI论文3篇。
来源:浙江大学机械工程学院,内容有改动